皮肤科临床研究正在经历一场快速变革,以满足临床试验更合理、更安全、患者负担更轻的新需求。在皮肤病学领域,以患者为中心的方法可应用于研究过程的各个阶段,从最早的发现和临床前测试阶段到临床试验、监管审批和上市后研究。这些步骤中的每一步都能从患者的意见中受益匪浅,因为患者的意见能为研究活动提供更相关、更可行的信息。
在这篇博文中,我们将探讨一种以患者为中心的战略性方法,用于规划和实施皮肤科临床试验。
了解以患者为中心的重要性
以患者为中心的方法的核心是围绕患者的特点和需求设计临床试验。让患者积极参与研发过程不仅是正确的做法,也是满足监管机构、医疗机构和支付方期望的必要条件。2020 年 6 月,FDA 发布了关于收集全面而有代表性的患者体验数据的指南,强调了减轻患者在试验中的负担的重要性,首先是设计一个经过充分审核并纳入患者意见的试验。本文件是四份以患者为中心的药物开发指导文件系列中的第一份,旨在阐述利益相关方应如何收集和提交患者体验数据以及其他相关的患者和护理人员意见,以支持产品开发和监管决策。
患者反馈的重要性还体现在产品开发和监管审批之外。在个性化医疗的趋势下,医疗服务提供者不仅要依靠现有的临床试验数据,还要依靠自己对患者的临床经验来制定治疗方案。此外,皮肤科领域的支付方决策也越来越多地受到实际证据的驱动,其中患者的依从性与后续疗效之间的关系是一个重要的考虑因素。
寻求赞助商和患者优先事项之间的一致性
申办者可能会认为患者对临床试验的看法或优先事项与自己不同,但事实通常并非如此。
当患者考虑参加皮肤病学临床试验时,他们正在寻求正确的诊断、获得成功治疗的可能性、改善皮肤状况和提高生活质量的希望--所有这些都不会给患者带来与参与研究相关的额外负担。患者还出于慈善或利他的愿望,希望在更大的范围内、在全球范围内帮助其他患有相同疾病的人。
对于申办者而言,临床试验的优先事项通常包括
- 良好的纳入-排除标准,以便正确诊断和招募人员
- 坚持治疗
- 学习保持率
- 可靠、高质量的数据为监管审批提供支持
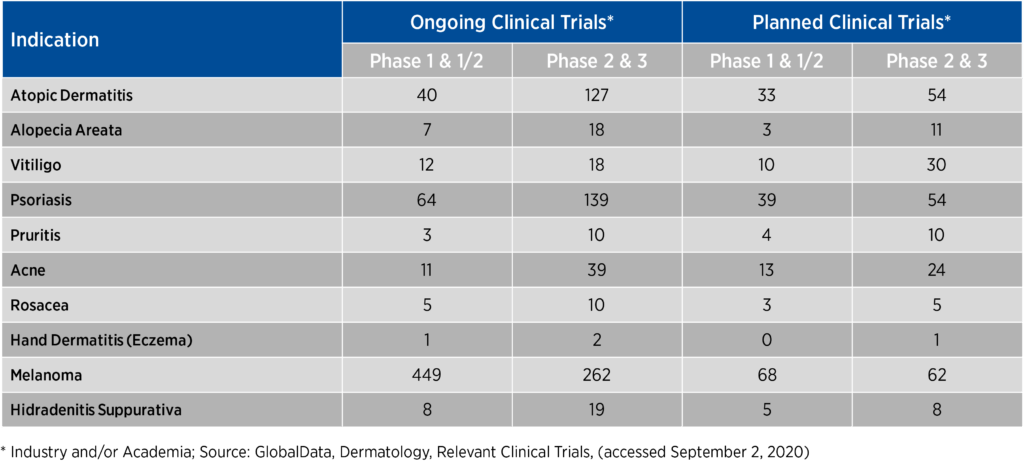
为了执行这些优先事项,申办者必须考虑与参与研究相关的负担程度,并将自己的观点与患者的观点统一起来。在竞争激烈的皮肤科领域,可能会有数百项试验同时针对某些适应症和患者群体进行招募(见图 1)。
图 1.竞争性皮肤病适应症中正在进行和计划进行的临床试验数量
以患者为中心,打造竞争优势
为了在皮肤科临床试验中创造差异化和竞争优势,申办者应在研究设计、招募和注册以及研究实施中采用以患者为中心的方法。
研究设计。在皮肤科临床试验中招募、注册和留住合适的患者,首先要制定以患者为中心的方案。让患者参与方案审查是申办者寻求患者直接反馈的一个机会,让患者了解在试验负担方面哪些是可行的、可接受的,以及建议的评估和终点是否合理,这对患者的治疗结果衡量非常重要。
招募和注册。在制定提高试验认知度的策略、创建试验信息以及编写从营销材料到知情同意书等所有面向患者的文件时,患者的参与对申办者也极具价值。
研究的实施。一项成功的研究不仅对患者及其家属有意义,而且从参与角度来看也是可行的。为了提高患者的参与度,申办者和合同研究组织必须深思熟虑,创造性地寻找方法,帮助患者和家属应对参与临床试验过程中可能遇到的挑战。如果患者被视为研究实施过程中的真正合作伙伴,他们就会继续参与。需要考虑的一些活动包括定期与患者进行沟通,包括让患者了解研究进展、完成情况和研究结果、以患者为中心的区域性活动,以及其他支持患者和帮助提高其生活质量的方式。
此外,与患者组织建立牢固的合作关系,成立患者咨询委员会和/或委员会,也有助于促进这些活动的开展。采用移动医疗等先进技术进行虚拟就诊、电子同意书或可穿戴设备和应用程序进行数据收集,也有助于减轻参与负担。
主要收获
在当今的监管环境和竞争激烈的临床试验环境中,将患者的意见和反馈纳入整个皮肤科产品开发过程至关重要。与具有深厚皮肤病学经验并以患者为中心的 CRO 合作,可以帮助申办者设计、开发和实施研究,使患者的优先权与申办者对成功的定义保持一致。要了解有关患者、法规和研究设计三者融合的更多信息,请观看我们的网络研讨会:皮肤科临床试验的基本策略。
在过去五年中,Premier Research 已经进行了 110 多项皮肤病研究,与数千名患者合作,我们知道如何让您的研究取得成功。单击此处与我们的皮肤科专家预约咨询。
1美国食品和药物管理局。FDA 以患者为中心的药物开发指南系列,用于在医疗产品开发和监管决策中加强患者声音的融入。见https://www.fda.gov/drugs/development-approval-process-drugs/fda-patient-focused-drug-development-guidance-series-enhancing-incorporation-patients-voice-medical。2020年11月18日访问。
