罕见癌症几乎占全世界所有新发癌症的四分之一,但罕见癌症并没有一个普遍采用的定义。在美国,罕见癌症的定义是每年每 10 万人中少于 15 例,而在欧盟,罕见癌症的定义是每年每 10 万人中少于 6 例。
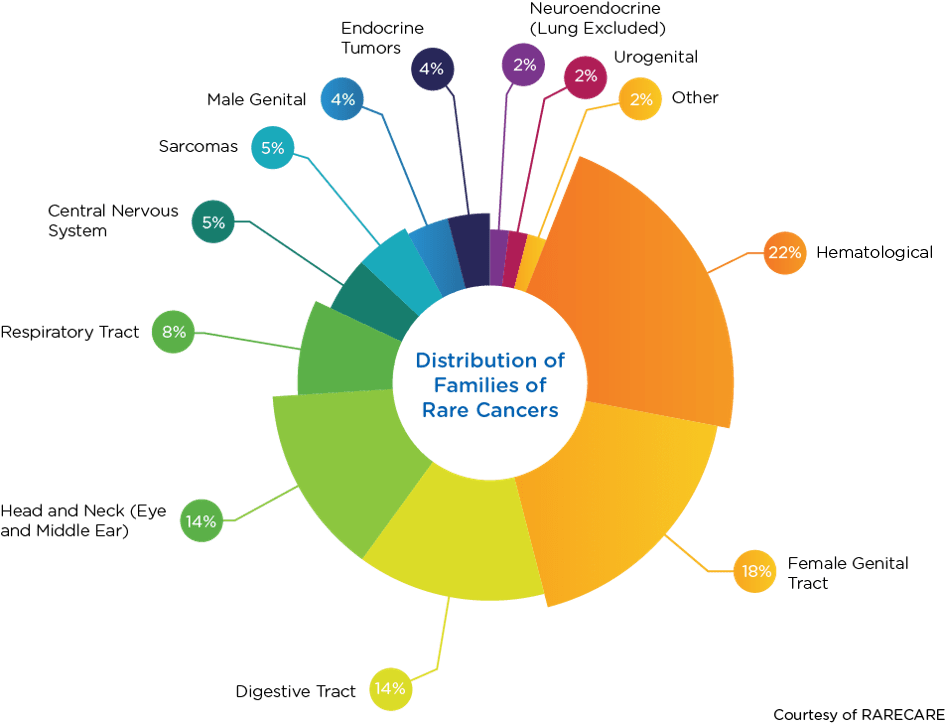
一直以来,癌症都是按部位和组织类型来划分的。但如今,人们越来越多地根据分子亚型对癌症进行分组。这种分子特征描述方法导致一些常见癌症被归类为罕见癌症。例如,黑色素瘤并不是罕见癌症,但当它被划分为分子亚型时,就可以被归类为罕见癌症的集合。如果以家族为单位进行分组,前四种罕见癌症类型分别是血液癌症(22%)、女性生殖道癌症(18%)、消化道癌症(14%)以及头颈部癌症(14%)。
根据分子亚型对癌症进行分组不仅改变了癌症的分类方式,也改变了在临床试验中研究新型疗法的方式。在这篇博文中,我们将探讨不断变化的罕见肿瘤格局和罕见癌症试验的新方法。
罕见癌症与罕见疾病有何不同
罕见癌症有时被称为肿瘤学中的罕见病。然而,尽管罕见癌症与罕见疾病有一些相似之处--即发病人群少、患者地域分散、诊断困难以及因样本量小而产生的统计难题,但也有一些关键的不同之处:
- 定义--罕见疾病的定义以流行率为基础,而罕见癌症的定义以发病率为基础
- 遗传基础--80% 的罕见疾病源于遗传,而罕见癌症中很少有明确的遗传因素
- 儿童患者- 75% 的罕见病会影响儿童,但所有儿童癌症都被视为罕见病
- 目标发现--罕见病是多种疾病的集合体,而罕见癌症都属于更广泛的癌症范畴,可能会从常见癌症的发现中受益
向精准医疗过渡
传统的癌症治疗方法是手术、放疗和化疗。随着遗传学和分子分析技术的进步,为患者提供更加个性化的治疗成为可能。现在,有了精准医学或个性化医学,治疗方法可以针对特定的患者群体,而不是依赖于 "一药治百病 "的模式。
随着我们对肿瘤分子特征认识的提高,不仅在靶向治疗方面,而且在肿瘤或组织诊断治疗的开发方面,都取得了巨大的飞跃。这些疗法不是基于肿瘤位置或组织类型,而是基于分子特征。迄今为止,已有三种肿瘤不可知疗法获得了监管部门的批准:
- 治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)肿瘤的彭博利珠单抗2017年版
- 拉罗替尼(Larotrectinib)将于 2018 年用于治疗 NTRK 基因融合的肿瘤,这种基因融合在不同癌症组织中约占 0.3%。
- 恩替瑞尼将于2019年用于治疗NTRK基因融合的肿瘤
Larotrectinib 是生物标志物驱动创新药物开发的一个重要范例。事实上,它是首个完全采用不可知适应症方法开发的药物。Larotrectinib 的批准是基于三项开放标签、单臂试验的疗效数据。这些试验都是篮式研究,纳入了从唾液腺癌到小儿纤维肉瘤等12种不同实体瘤适应症的患者,所有患者都有相同的NTRK基因融合。所有患者都接受了拉罗替尼治疗,总反应率达到 75%。更令人印象深刻的是,批准该药的依据是全部 12 个适应症中仅 55 例患者的拉动数据,而且从第一阶段到加速批准仅用了三年时间。
推动肿瘤药物的无缝开发
在肿瘤学领域,尤其是罕见肿瘤学领域,越来越多的项目已从传统的药物开发途径过渡到无缝途径,将药理学研究、治疗探索研究和确证研究结合起来,以寻求加速审批(见图 2)。
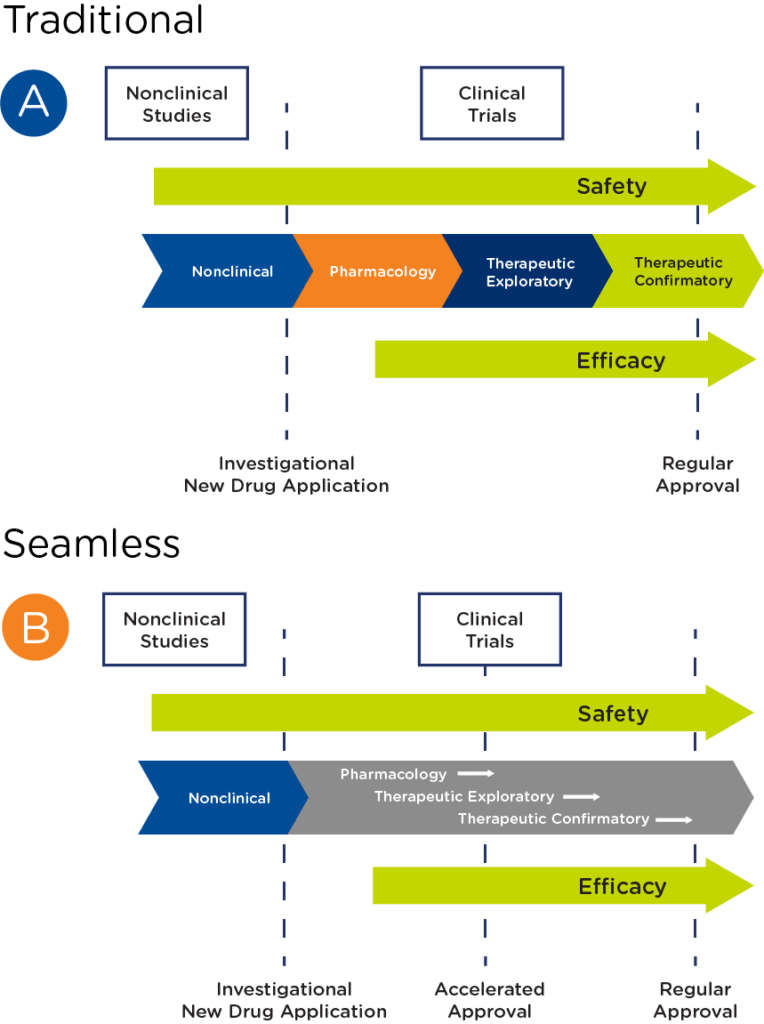
采用无缝方法开发罕见肿瘤药物所面临的挑战包括
- 患者人数少--鉴于适应症的罕见性,最终数据集中的患者人数将很少
- 接触患者--要接触到所需的患者人数,研究需要在广泛的地理范围内进行,这就增加了后勤工作的复杂性
- 研究设计注意事项- 在准备设计罕见肿瘤学研究时,您需要明确定义试验目标、研究人群和亚组,以及用于评估反应的方法。在定义研究人群时,必须考虑如何处理初始治疗后病情恶化的患者,尤其是以总生存期为终点的患者。关于反应评估,生物标志物在衡量反应方面可能比肿瘤测量更敏感,尤其是对于靶向疗法和免疫疗法而言。
- 纳入基因或生物标志物测试--您需要在项目早期选择合适的测试工具和测试方法,确保其既符合开发阶段的目的,又能支持进一步开发,并最终实现商业化。
- 制造 - 通过加速计划,制造部门需要更快地满足营销申请的要求
主要收获
随着时间的缩短,如何在临床、生产、监管和营销等各学科之间达成一致以获得批准也至关重要。Premier Research 提供全方位的产品开发咨询和临床开发服务,帮助您优化罕见肿瘤药物的开发。如需与我们的专家进行交流, 请单击此处。
1基于 RARECARENet 的数据。见 www.rarecare.eu。
2改编自Theoret MR, Pai-Scherf LH, Chuk MK, et al. Clin Cancer Res October 15 2015 (21) (20) 4545-4551; DOI: 10.1158/1078-0432.CCR-14-3244
