对于针对未满足医疗需求的新疗法,尤其是针对罕见病的新疗法,无论怎样强调都不为过。毕竟,目前只有约 400 种 "孤儿药 "获得批准,这意味着 95% 的罕见病缺乏一种获得批准的治疗方法。
现在是好消息:美国和欧洲的监管机构认识到需求的规模和严重性,提供了相关规定,以减轻审查和批准这些药物所需的巨额费用和延长的时间。美国食品药品管理局和欧洲药品管理局采取了类似的策略,加快审批速度,让患者更早地获得改变生命甚至挽救生命的新药。
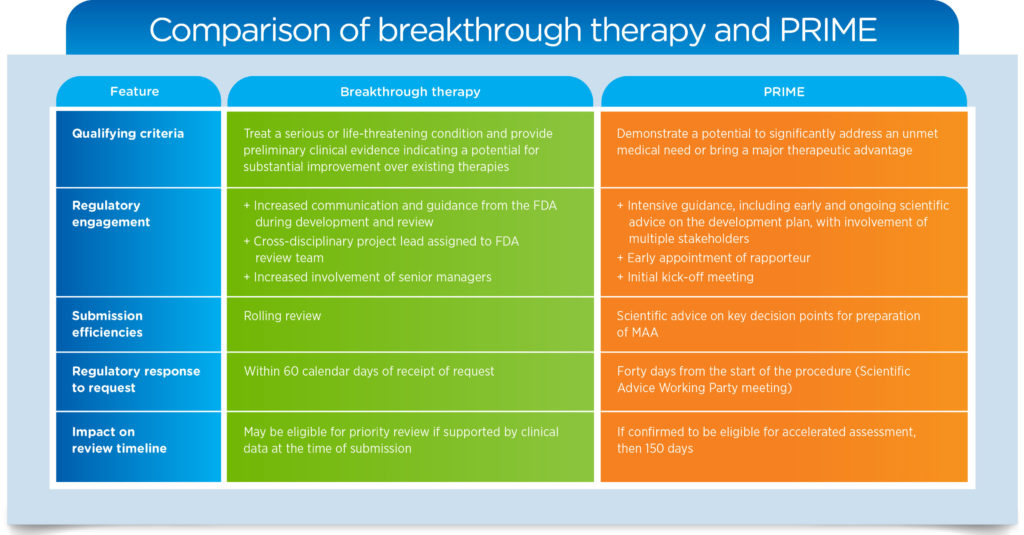
您可以在上面看到这些规定的主要内容--FDA 的突破性疗法认定和 EMA 的 PRIME(PRIority MEdicines)计划--以及符合条件的申办者如何才能最好地利用这些途径。欲了解有关此主题的更多信息,请下载我们的白皮书《美国和欧洲的快速监管途径导航》。
