尽管我们对导致癌症的复杂基因、分子和免疫学因素的认识不断进步,但肿瘤学的成功率和获批可能性仍然很低。根据生物技术创新组织(BIO)最近进行的一项研究,在2006年至2015年期间,近三分之一进入第二阶段研究的药物未能取得进展。在该研究涵盖的14个主要疾病领域中,肿瘤药物获批的可能性最低,仅为5.1%,但也是获批最快的。在肿瘤领域,血液肿瘤治疗药物的获批几率是实体瘤治疗药物的两倍。
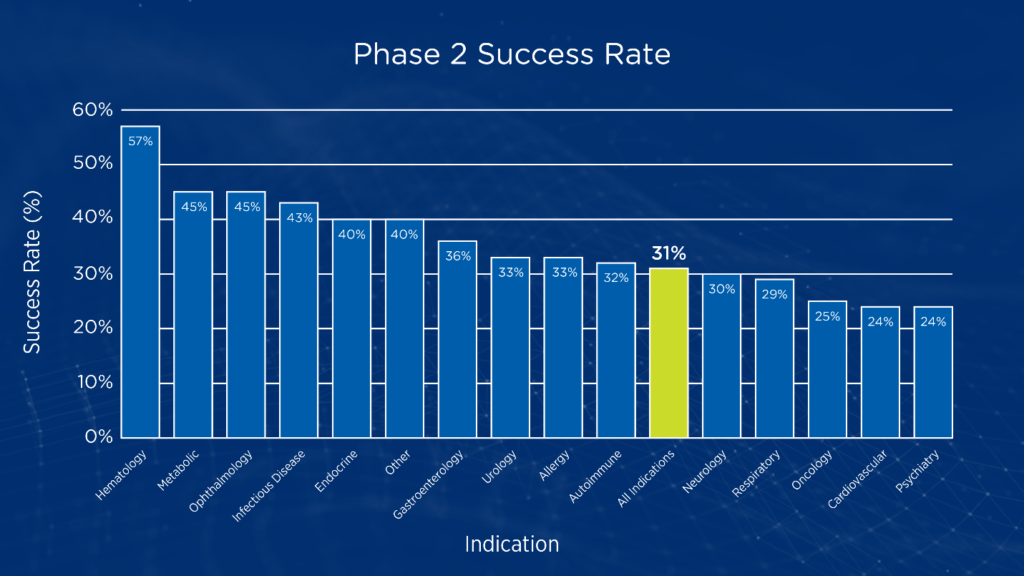
1 期研究通常侧重于剂量测定和建立初步的安全性概况,而 2 期研究通常是临床开发的第一阶段,目的是在人体受试者中测试概念验证。2 期研究也是申办者必须决定是继续进行大型、昂贵的 3 期研究,还是终止开发的阶段。在肿瘤学领域,从 2 期研究过渡到 3 期研究的成功概率仅为 24.6%(见图 1)1。
图 1.按病区分列的第二阶段过渡成功率1
早期肿瘤药物为何失败
导致肿瘤试验 2 期转归成功率低的因素很多,包括最大耐受剂量 (MTD) 不准确、数据不足以提供药物对所选适应症有效的统计置信度,以及未能探索包括标准治疗在内的联合用药。在日益强调精准医疗的当今肿瘤学领域,缺乏有效的生物标志物来预选研究参与者以确定那些最有可能产生反应的患者,也会对二期研究的成功产生不利影响。根据 BIO 的研究,在不同的疾病领域,使用筛选生物标志物可将 2 期研究成功的概率从 28% 提高到 46%。
如何优化成功的可能性
随着精准医疗的出现,早期肿瘤试验的开展方式也发生了转变,包括越来越多的一期试验报告了初步反应率。这种变化至少部分归因于适应性试验设计,其目的是限制接受无效剂量或治疗的患者人数,同时及早发现潜在的疗效信号。
随着我们对癌症遗传基础认识的不断深入,越来越多的 1 期研究是由共同的作用机制或分子改变而不是特定的疾病类型驱动的。因此,除了剂量测定和安全性评估等常规目标外,这些 1 期研究还旨在选择最有希望在 2 期研究中得到应用的适应症。自适应设计方法非常适合帮助申办者优化剂量和给药方案,同时缩小感兴趣的适应症范围。
从历史上看,大多数一期肿瘤试验都依赖于标准的 3+3 剂量递增设计来确定二期推荐剂量(R2PD)。遗憾的是,研究表明,在采用 3+3 设计的试验中,只有三分之一的试验真正成功确定了 MTD。2标准 3+3 剂量递增设计的另一个潜在局限是,靶向疗法和免疫疗法可能不会产生剂量限制毒性,因此可能需要以最佳生物剂量(OBD)而非 MTD 为终点。
除了标准的 3+3 剂量递增设计外,还有一种适应性设计方法,即持续再评估法,它使用基于统计模型的剂量递增算法来帮助估计 MTD。在这种方法中,渐进算法允许在每位患者接受治疗后改变剂量水平。由于剂量升级可能会更快,因此有可能比固定样本设计更快、更准确地确定 MTD 或 R2PD。
进一步了解早期肿瘤试验中的适应性设计方法
连续再评估法只是适应性设计的一个例子,它可以帮助申办者优化早期肿瘤学研究。欲了解更多有关如何利用适应性设计加快疗效信号检测时间的信息,请下载我们的白皮书《 早期肿瘤学中的适应性试验设计》:最大限度降低风险并加快时限。
[1]Thomas DW 等:《2006-2015 年临床开发成功率》。生物技术创新组织,华盛顿特区。2016 年 6 月。2020年5月16日访问。
[2]Reiner E, Paoletti X, O'Quigley J.标准 I 期临床试验设计的运行特征。Comput Stat Data Anal.1999;30(3):303-315.
[3]Wheeler GM, et al.BMC Med Res Methodol.2019;19:18.
