透皮给药和局部给药系统(TDS)是一种重要的剂型,可通过皮肤将药物输送到局部组织或提供全身给药。这些药物产品为患者提供了许多优势,但开发起来可能具有挑战性。2019 年 11 月,FDA 发布了一份名为《透皮和局部给药系统--产品开发和质量考虑因素》的指导草案:[1]该文件提供了 FDA 目前在产品设计、药品开发、产品质量以及 TDS 性能和安全性评估方面的思路。
为什么要开发 TDS 产品?
与其他给药途径相比,TDS 有许多优点。首先,TDS 可以提高患者的依从性,尤其是对有吞咽困难或胃肠道(GI)刺激症状的患者。方便和易于使用是开发 TDS 的其他主要原因。从药物暴露的角度来看,通过 TDS(经皮肤)进行全身吸收可避免在酸性胃环境中可能发生的酶消化或药物水解。它还避免了首过代谢,从而提高了某些活性成分的全身吸收水平。此外,由于 TDS 的控释机制,在某些情况下,药物暴露的持续时间可以设计为延长多天。
全港数据系统 - 开发考虑因素
在开发 TDS 产品时,应在产品开发的早期阶段对一些考虑因素进行评估:
- 活性成分的皮肤渗透能力如何?在皮肤上使用是否安全?
- TDS 配方是否可能刺激皮肤或使皮肤过敏?
- 使用 TDS 的持续时间是多长?产品将施用在何处?施用地点是否需要轮换?
- 疗效所需的药物浓度是否特征明确?能否将足够的剂量纳入 TDS?
- 能否针对适应症和目标人群开发出合理大小的补丁?
TDS 主要有两种类型,一种是储液型,另一种是基质型,两者的区别在于活性成分是如何融入产品中的。基质型 TDS 产品将活性成分溶解或悬浮在含有粘合剂、渗透增强剂、防腐剂和其他辅料的基质中。
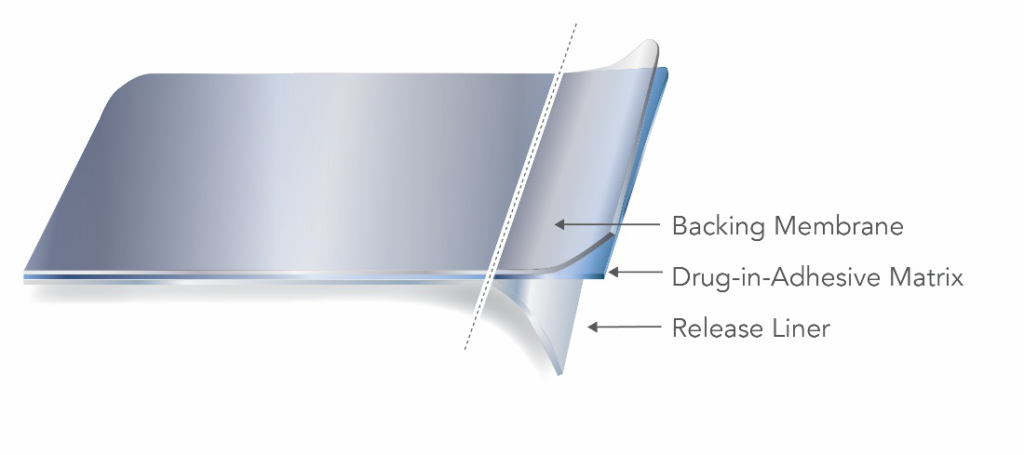
储藏式 TDS 产品在背膜和与皮肤接触的半透膜之间的热封区域中含有药物。
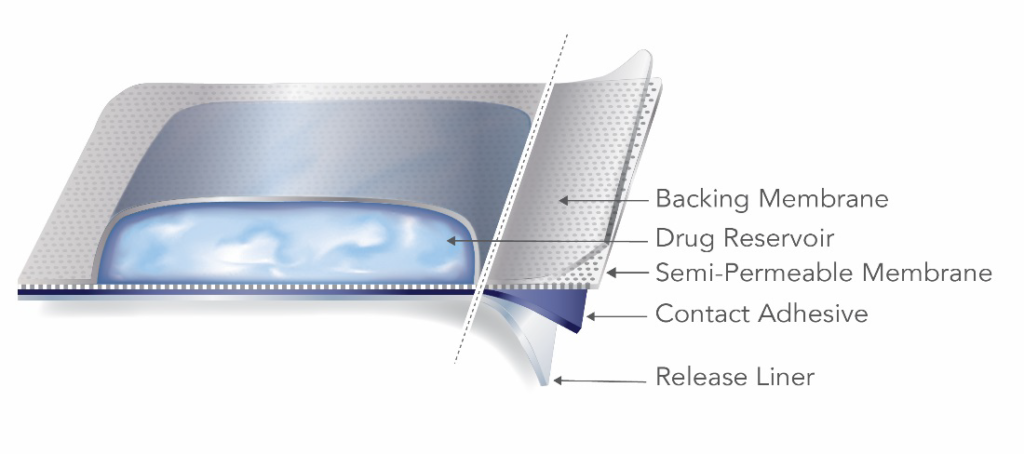
储液器 TDS 设计存在固有的故障隐患和安全风险。对储液器 TDS 施加强大的压力会导致产品破裂,以不受控制的方式释放含药储液器的内容物。因此,FDA 建议制造商和申请人将开发重点放在矩阵式 TDS 上。该指南进一步指出,"强烈建议申请人在开发过程的早期阶段就咨询药品质量办公室,然后再进行储药箱设计"。
TDS 的监管考虑因素
从监管的角度来看,TDS 产品属于组合产品,必须遵守21 CFR 第 4 部分 A 子部分(组合产品的现行药品生产质量管理规范 [CGMP]要求)[2]。此外,TDS 的开发人员应了解 21 CFR 第 820.30 部分中概述的设计控制规定,以确认产品各组成部分之间不存在负作用,并确保组合使用的组合产品安全、有效且性能符合预期。
优质目标产品简介(QTPP)
FDA 在指南中建议,在开始开发 TDS 产品之前,申请人应建立质量目标产品档案 (QTPP),概述产品的质量特征,并考虑其安全性和有效性。QTPP 可包括以下内容:
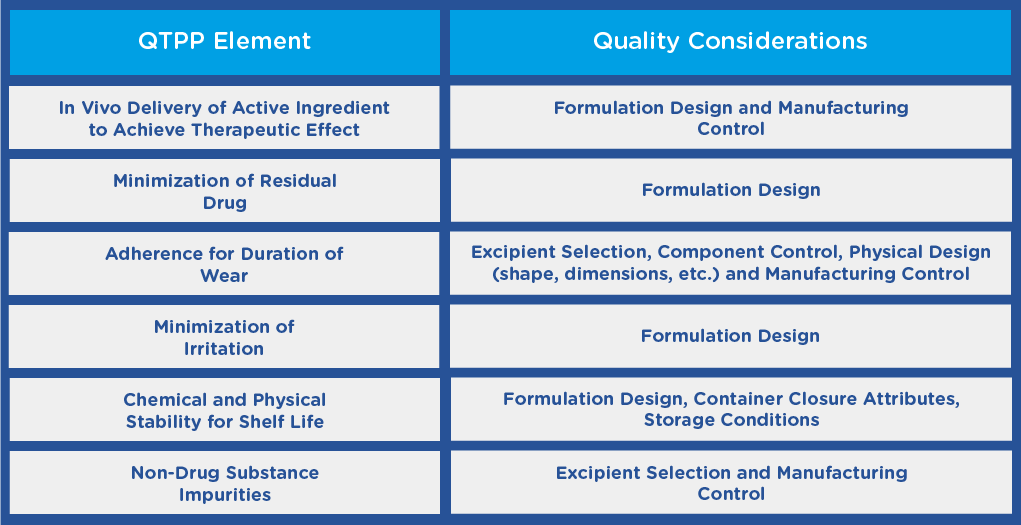
根据不同的适应症或其他功能要求,还可能存在其他 QTPP 要素,如成品的尺寸,这可能取决于 TDS 产品在身体上的应用位置。
关键质量属性
在产品开发初期,申请人应制定一份关键质量属性 (CQA) 清单。以 QTPP 为指导,申请人应列出 CQA,这些 CQA 定义了物理、化学、生物或微生物属性或特征,这些属性或特征应在适当的限度、范围或分布内,以确保达到预期的产品质量。随着获得更多信息,这份 CQAs 清单可能会在产品开发生命周期中不断变化。
FDA 指南总结了药物物质、药物产品和 TDS 辅料的典型 CQA。对于 TDS 而言,值得注意的是对粘合剂的鉴定;指南概述了对作为原材料的粘合剂聚合物、作为层压材料的粘合剂(在没有活性药物成分[API]和其他辅料的情况下)以及最终产品中的粘合剂(连同药物物质和其他辅料及成分)进行评估的参数。
TDS 的另一个重要属性是印在产品上的识别信息。这一点应在开发初期确定,以确保标签工艺或用于印刷的油墨不会与 TDS 发生相互作用,并在可提取/可渗透研究中对油墨进行评估。申请者应注意,透明或颜色与人体肤色一致的产品会使患者难以找到 TDS;这可能会导致潜在的用药错误(例如,如果产品在不知情的情况下脱落或因使用多种产品而脱落)。因此,建议在底膜上印上足够对比度的油墨,以便于识别。
申请时应提交的信息
新指南概述了 TDS 产品上市申请中应提交的质量信息。该指南介绍了申请中药品开发部分应包含的信息,包括对注册批次和参展批次的要求。对于 TDS,注册/参展批次应由三种不同的层压板制成,每种层压板使用不同批次的原料药、粘合剂、衬底和/或产品的其他关键要素。释放和稳定性取样应代表层压板的整个长度和宽度,以证明生产过程的稳健性。由于 TDS 产品对生产过程中的微小差异很敏感,因此申请中应包括临床批次、BE 批次、注册/参展批次和拟议商业批次的比较表。 对于每一批产品,该表应具体说明所使用的生产工艺、关键工艺过程测试结果、产量和调节数据。
该指南还介绍了在准备上市申请时应完成的 TDS 产品特征研究、生产信息和控制评估。其中包括制剂结晶可能性评估、残留药物评估、热量对给药的影响以及粘附性测试。应进行体外和体内粘附性测试,其中体内评估应代表实际使用情况。
结论和建议
TDS 的开发非常重要,因为有许多患者受益于这些产品。新的指南草案提供了一个亟需的视角,说明了 FDA 对开发这些产品的期望,以及申请人应如何开发和适当描述这些产品,以便申请上市。除了新指南中提供的信息外,我们还建议在开发项目早期与 FDA 会面,这将有助于明确特定项目的非临床、临床、质量和监管要求。
贵公司是否正在考虑开发 TDS 产品?Premier Research 旗下的 Regulatory Professionals (RPI) 公司的专家们在 TDS 产品开发的各个阶段都提供过协助,可以为您的项目提供指导和专业知识。如需了解更多信息,请联系我们。
[1]药物评价与研究中心。(2019年11月)。透皮和局部给药系统--产品开发与质量。取自https://www.fda.gov/regulatory-information/search-fda-guidance-documents/transdermal-and-topical-delivery-systems-product-development-and-quality-considerations
[2]药物评价与研究中心。(2017年1月)。组合产品的现行良好生产规范要求》。取自https://www.fda.gov/regulatory-information/search-fda-guidance-documents/current-good-manufacturing-practice-requirements-combination-products
