设计和进行基因治疗试验是一项复杂的工作。了解、规划并克服这些研究运作中的无数挑战,将有助于你为有未满足医疗需求的患者带来安全、突破性的治疗。
在这篇博文中,我们介绍了一个案例研究,作为探讨基因治疗试验的关键研究设计考虑因素的框架,并提供解决这些障碍的策略。
背景介绍
本案例研究是基于Premier Research公司对一项救援性的1/2期基因治疗试验的操作工作,该试验涉及使用专门设备进行基因治疗的局部给药。该研究由两部分组成,其中第二部分包括一个假手术(见图1)。
- A部分:由三个队列和剂量水平组成的剂量递增研究,在每个剂量之间进行安全审查。
- B部分:一旦找到最佳剂量,将研究参与者随机分配到基因治疗或假手术中,并进行后续跟踪。
图1.案例研究设计
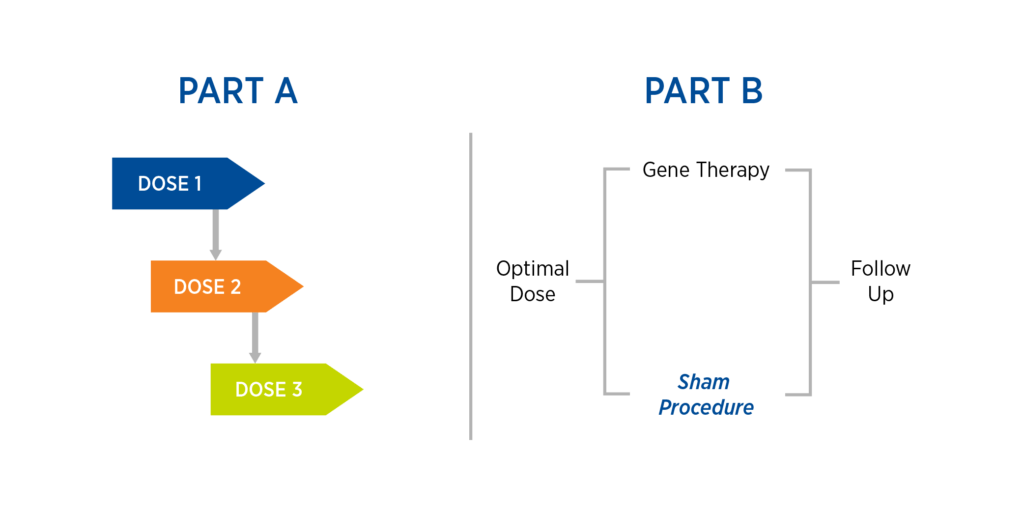
值得注意的是,该方案迄今已经历了五次以上的修订。B部分的假手术是应FDA的要求加入的。当该方案在西欧提交时,没有发现重大问题。然而,在一个欧盟国家,伦理委员会最初并没有批准使用假手术。Premier与我们的国内调查员合作,他们都同意提交关于在B部分使用假手术的支持信。这些信中强调的一个关键因素是,虽然患者群体被认为是脆弱的,但鉴于可用的治疗方法有限,使用假手术不会造成不必要的负担。另一个重要因素是,使用假手术可以进行安慰剂控制。
基因治疗研究规划的关键考虑因素
以下是研究过程中涉及的一些重要考虑因素。
可行性。 我们对将要进行研究的地理区域进行了重新评估,并确认北美和西欧都是有关疾病的高发地区。然后我们与这些国家和地点重新建立了沟通,以提交适当的文件。
选址。鉴于试验B部分的随机性,决定在西欧需要更多的国家和地点。选址过程包括确定和引进具有科学和临床经验的站点--并能接触到被调查疾病的患者。此外,该过程还包括筛选以前的经验,不仅是在基因治疗方面,还包括从监管和方案设计的角度满足国家和地方的要求。场地选择标准还包括基因治疗管理和假手术所需的外科技术和专业设备,以及接收、储存和准备基因治疗所需的设施和标准操作程序。
招生。尽管在北美和西欧,有关疾病的发病率很高,但预计许多研究参与者将来自试验进行地的边界之外。随着互联网的出现和宣传团体的影响越来越大,越来越多的患者将他们的护理工作掌握在自己手中,并寻求他们可能有资格参加的临床试验。因此,考虑跨境注册是很重要的,需要制定流程和程序来确保这些病人的顺利过渡。
长期随访。基因治疗试验需要长期随访,随访期从5年到15年不等,取决于国家和所使用的基因治疗的类型。鉴于基因疗法经常在患有严重疾病的病人身上进行调查,你需要考虑到有一定比例的病人无法在长期随访期中存活。
研究药物管理的物流。 由于基因治疗给药或假手术需要专门的外科手术,将为研究中的每个病人制作一个定制件。由于该试验包括西欧的站点,我们需要确保必要的设备部件获得CE标志。为了最大限度地提高效率和以病人为中心,我们决定在这项试验中采用枢纽和辐条模式,即专业外科中心作为研究药物管理的枢纽,转诊中心作为辐条,负责招募、筛选和当地随访。
制造。基因治疗的制造是一项昂贵的工作,在临床项目的整个过程中,将制造过程设计成一个连续的过程至关重要。这包括有一个备份计划和对该备份计划的备份,以及对已生产的药物有一个滚动的稳定性计划。
请继续关注我们的第三篇文章,探讨COVID-19期间基因治疗试验的操作挑战。在过去五年中,Premier Research在多个治疗领域进行了60项基因和细胞治疗试验,包括肿瘤学、血液学、神经学和罕见疾病。点击这里,安排与我们的基因治疗专家进行咨询。
