要开发出成功的基因疗法,申办者必须开展研究,在安全监督和可靠临床证据的需求与寻找合适患者、将患者与合格研究机构配对、提供知情同意书以及确认患者有能力并承诺满足所有方案要求等挑战之间取得平衡。
本文是基因疗法开发博客系列三部曲的第二部分,我们将探讨设计基因疗法试验的关键注意事项。
早期基因治疗试验的注意事项
基因治疗产品有别于其他类型的药品,其独特性可能会影响研究设计。首先,基因治疗产品可能存在风险,如生物活性延长、免疫原性或脱靶效应的可能性。这些疗法的施用还可能涉及侵入性程序。此外,临床前数据并不总是具有参考价值,因为进行传统的临床前药代动力学研究并不总是可行的。
鉴于这些产品特性,基因治疗试验的设计必须考虑安全程序或控制免疫原性,并利用化学、制造和控制数据来评估适当的安全性和给药方案。研究设计还必须解决伦理问题。例如,在使用具有已知免疫原性反应的 AAV 疗法时,目前的想法是每位患者只能接受一次该 AAV 血清型的剂量。参与首次人体剂量递增研究的患者很可能会接受无效剂量水平的治疗,并且可能没有资格接受另一剂量的治疗。
研究设计的要素
图 1.基因治疗研究设计概述
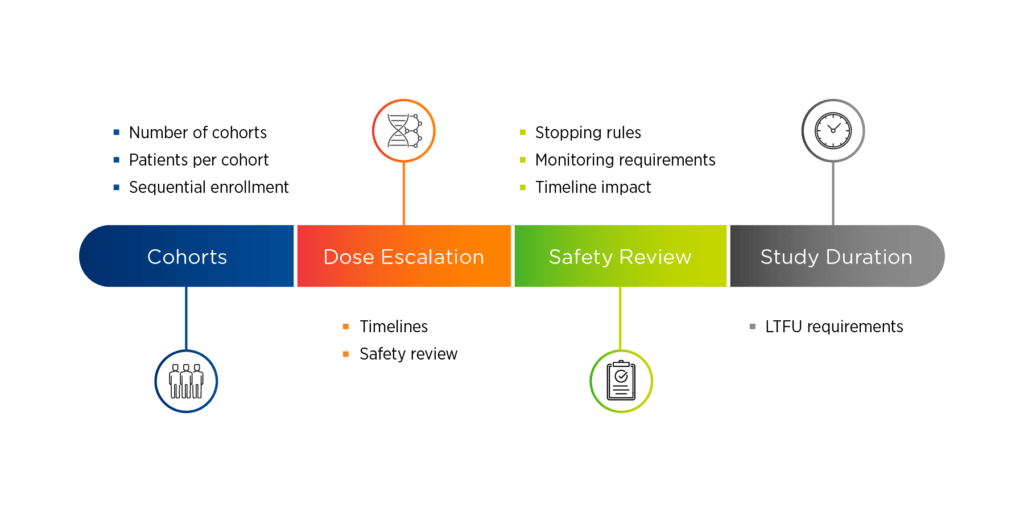
基因治疗研究设计的四个关键要素是
1.队列。申办者需要确定组群的数量、每个组群的患者人数以及这些患者的入组方式。顺序入组,即每次只入组一名患者,在人类基因治疗试验中最为常见。另一个需要考虑的问题是安慰剂对照的使用,FDA 可能赞成,但 EMA 可能不赞成。一种选择是使用对照组,可以通过将患者随机分配到一个剂量延迟的磨合期来实现,这样他们就可以作为自己的比较对象。
2.剂量升级。 如果要进行剂量升级,就需要制定安全审查的时间表。这些安全性审查可以在单个患者之间进行,也可以在组群之间进行。1 / 2 期基因治疗试验中常见的研究设计是先进行剂量升级,然后再扩大剂量。
3.安全审查。 频繁的安全审查是基因治疗研究的固有特点,并将伴随着停止规则和监测要求,这可能会对研究时间表产生影响。
4.研究持续时间。 申办者需要了解与候选疗法相关的长期随访要求。
研究设计还必须考虑到数据安全委员会的作用,该委员会是一个公正的调解机构,客观地评估患者数据,以评估安全性,有时也评估疗效,然后才能推进研究。
矢量考虑因素
所用载体的类型会影响细胞运输和免疫抑制的需要。基于 AAV 的基因疗法属于转基因生物,很可能需要冷链运输。在安排患者筛查访问时,还必须考虑药物的稳定性。从历史上看,免疫抑制剂并不总是与基于 AAV 的基因疗法同时使用,尤其是在向中枢神经系统给药时。但如今,由于与药物相关的免疫反应可能会使药物在发挥预期疗效之前失去活性,免疫抑制剂在所有类型的体内 AAV 疗法中的使用越来越多。通常情况下,免疫抑制剂会在基因治疗用药前使用,以抑制对载体的免疫反应,然后在用药后逐渐减量。
对于自体细胞转移,如使用慢病毒载体,细胞可在医院本地或集中在生产设施中进行改造。身份链至关重要,要避免混淆,就必须制定流程,确保细胞或细胞容器上清楚标明患者身份。监管链还必须通过记录生产过程中每一步的细胞责任人来确认。此外,了解和确定运输要求也很重要,包括细胞是活体运输还是低温保存以提高稳定性。体外 基因疗法是否需要使用免疫抑制剂取决于表面蛋白的免疫原性。化疗通常用作调节剂,但如果存在免疫原性表面蛋白,则可能需要添加免疫抑制剂。
如果需要使用免疫抑制剂治疗,监测依从性非常重要。申办者可以考虑使用电子日记设备,因为不遵从免疫抑制剂治疗不仅存在安全隐患,还会危及数据质量。
协议审查
让主要利益相关者参与方案审查有助于最大限度地减少方案修订的需要,因为方案修订可能既费钱又费时。请关键意见领袖审核方案,并让他们认可建议评估的类型和时间安排至关重要。他们可能会发现终点或研究设计中被忽视的问题。患者权益团体是另一个宝贵的资源,因为他们可以从患者及其家属的角度来审查方案,并成为研究参与者的潜在资源。最后,尽早并经常与监管机构接触可以帮助申办者发现并解决方案中潜在的问题或疑虑。
在本系列博客的第三部分,我们将讨论选择合适的基因治疗机构以及优化患者注册和参与的策略。
在过去五年中,Premier 公司开展了 60 多项细胞和基因治疗研究,将我们在病毒载体方面的丰富经验与肿瘤学、罕见病和儿科研究方面的深厚治疗专业知识相结合。单击此处了解更多有关 Premier 如何帮助推进基因治疗研究的信息。
